- Làm thế nào để cân bằng một phương trình hóa học
- Cân bằng trong dãy kim loại-phi kim
- Phương pháp cân bằng phương trình chẵn lẻ
- Phương pháp từ phần tử phổ biến nhất
- Phương pháp cân bằng phương trình sử dụng hệ số thập phân
- Phương pháp đại số cân bằng phương trình
- Cân bằng phương trình Al+HNO3=Al(NO3)3+NH4NO3+H2O đặc & loãng
Cân bằng hóa học là một trong những bài tập mà chúng ta sẽ luôn gặp khi học hóa học. Và bài tập hôm nay của chúng ta sẽ cân bằng phương trình Al + HNO3 = Al(NO33 + NH4NO3 +H2O đặc & loãng . Vậy phương trình này sẽ cân bằng như thế nào ? Các em cùng giải bài tập nào ? Nào các em , trước tiên chúng ta cùng ôn lại một số cách cân bằng phương trình hóa học nhé .

Làm thế nào để cân bằng một phương trình hóa học
Đối với môn Hóa học, cân bằng phương trình luôn là nỗi ám ảnh của học sinh. Nhưng thật ra rất đơn giản để cân bằng các phương trình hóa học này. Tuy nhiên, có những phương trình mà nhiều chất tham gia phản ứng và tạo ra nhiều sản phẩm khiến học sinh khi gặp bài toán khó sẽ không cân bằng được phương trình. Dưới đây là một số phương pháp cân bằng phương trình giúp học sinh làm bài tập cân bằng phương trình hóa học dễ dàng, nhanh chóng và chính xác.
Trước hết học sinh cần thuộc lòng trình tự cân bằng một phương trình hóa học:
Bước 1: cân bằng nhóm nguyên tử (OH, NO 3 , SO 4 , CO 2 , PO 4 ..)
Bước 2: Cân bằng nguyên tử Hydrogen
Bước 3: cân bằng nguyên tử oxy
Bước 4: cân đối các yếu tố còn lại.
Cân bằng trong dãy kim loại-phi kim
Cân bằng một phương trình hóa học theo dãy Kim loại-Phi kim có nghĩa là chúng ta sẽ cân bằng số nguyên tử của kim loại trước, sau đó là phi kim, sau đó là Hiđro và sau đó là oxi.
Vd: CuFeS 2 + O 2 -> CuO + Fe 2 O 3 + SO 2
Vì nguyên tử Cu đã cân bằng nên bậc 1 của cân bằng sẽ là: Fe rồi đến Cu, S, O rồi nhân đôi hệ số ta có kết quả:
4CuFeS 2 + 13O 2 = 4CuO + 2Fe 2 O 3 + 8SO 2
Phương pháp cân bằng phương trình chẵn lẻ
Đây là một trong những cách dễ dàng và được sử dụng rộng rãi nhất để cân bằng phương trình hóa học. Với phương pháp này, học sinh có thể sử dụng phương pháp tính chẵn lẻ, được áp dụng như sau:
- Khi phương trình cân bằng nghĩa là số nguyên tử của nguyên tố vế phải bằng số nguyên tử của nguyên tố vế trái tức là số nguyên tử của nguyên tố vế trái bằng chẵn , thì Số nguyên tử của nguyên tố đó ở vế phải cũng phải là số chẵn.
- Vì vậy, nếu trong phương trình nếu một trong các số nguyên tử của bất kỳ nguyên tố nào là số lẻ, thì nó phải được nhân đôi.
Vd: Ta lấy lại ví dụ trên: Fe + O 2 -> Fe 2 O 3
Số nguyên tử Fe ở vế trái là số lẻ, vế phải là chẵn nên ta nhân Fe ở vế trái với 2. Oxy ở vế trái là chẵn, vế phải là lẻ nên ta cũng nhân 2 bằng số nguyên tử oxi ở vế phải.
2Fe + O 2 -> 2Fe 2 O 3
Lúc này số nguyên tử 2 bên là chẵn, ta chỉ cần cân bằng lại cho số nguyên tử 2 bên bằng nhau.
4Fe + 3O 2 = 2Fe 2 O 3
Phương pháp từ phần tử phổ biến nhất
Phương pháp phần tử phổ biến nhất có nghĩa là bất kỳ phần tử nào có mặt trong hầu hết các hợp chất trong phương trình được cân bằng, chúng tôi sẽ chọn phân tích các phân tử trước.
Vd: Cu + HNO 3 -> Cu(NO 3 ) 2 + NO + H 2 0
Trong phương trình này, nguyên tố Oxy xuất hiện nhiều nhất trong hầu hết các hợp chất nên sẽ cân bằng Oxy trước, sau đó mới đến các nguyên tố khác.
Vế trái có 8 oxi, vế phải có 3 oxi. Vậy bội số chung nhỏ nhất của 8 và 3 là 24 nên hệ số của HNO 3 là 24/3=8
Vậy cân bằng phản ứng là: 3Cu + 8HNO 3 = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
Phương pháp cân bằng phương trình sử dụng hệ số thập phân
Phương pháp này áp dụng như sau: đặt hệ số cho các chất phản ứng, có thể là số nguyên tố hoặc phân số miễn là số nguyên tử ở hai vế bằng nhau. Sau đó nhân lên để loại bỏ mẫu số chung ở cả hai bên.
Vd: Fe + O 2 -> Fe 2 O 3
Đầu tiên ta cộng hệ số trở thành: 2Fe + 3/2O 2 -> Fe 2 O 3
Lúc này số nguyên tử ở hai vế bằng nhau. Sau đó, chúng tôi nhân với giải mẫu, mà trong phương trình sẽ nhân với 2.
Kết quả là: 4Fe + 3O 2 = 2Fe 2 O 3
Phương pháp đại số cân bằng phương trình
Học sinh lần lượt đặt các hệ số a, b, c… vào công thức hai vế của phương trình rồi lập PTHH chứa các ẩn số trên theo nguyên tắc số hiệu nguyên tử của nguyên tố trước và sau phản ứng là bằng nhau. Bạn sẽ được một hệ phương trình chứa ẩn số, hãy giải hệ phương trình này và đưa các hệ số tương ứng vừa tìm được về phương trình phản ứng và giải mẫu (nếu cần).
Với bài toán cân bằng phương trình hóa học FeS 2 + O 2 –> Fe 2 O 3 + SO 2 , ta thấy, vế trái số nguyên tử O 2 chẵn với hệ số bất kỳ còn vế phải, trong SO 2 oxi là số chẵn nhưng trong Fe 2 O 3 là số lẻ nên phải tăng gấp đôi. Sau đó cân bằng các hệ số còn lại. 2Fe 2 O 3 –> 4FeS 2 –> 8SO 2 + 11O 2 , thay PTPU ta được phương trình cân bằng là 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 .
Cân bằng phương trình Al+HNO3=Al(NO3)3+NH4NO3+H2O đặc & loãng
Dung dịch:
- Điều kiện phản ứng Al phản ứng với HNO3: Không
- Cách tiến hành phản ứng cho Al tác dụng với HNO3: Nhỏ từ từ từng giọt dung dịch axit HNO3 vào ống nghiệm có lót sẵn lá nhôm (Al).
- Hiện tượng phản ứng hoá học Cho Al tác dụng với HNO3: Chất rắn màu trắng là nhôm (Al) tan dần trong dung dịch axit HNO3, trong dung dịch xuất hiện bọt khí và hoá nâu trong không khí là nitơ oxit (NO). )
Vậy ta có phương trình
Al (Nhôm ) + HNO 3 ( Axit Nitric ) → Al(NO 3 ) 3 ( Nhôm Nitrat ) + NH 4 NO 3 ( Amoni Nitrat ) + H 2 O ( Nước )
PHƯƠNG TRÌNH HÓA HỌC
| Al | + HNO3 | → | Al( NO3 ) 3 | + NH 4 KHÔNG 3 | + 2H 2 Ô |
| Nhôm (đặc) (trắng bạc) | (dung dịch axit nitric) (không màu) | Nhôm nitrat (rắn) | amoni nitrat | (chất lỏng) (không màu) | |
| M = 8 | m = 30 | M = 8 | M = 3 | M = 9 |
Cân bằng phương trình : 8 Al + 30 HNO 3 → 8 Al(NO 3 ) 3 + 3 NH 4 NO 3 + 9 H 2 O
Bài tập về cân bằng phương trình
Cho phản ứng hóa học sau: Al + HNO 3 → Al(NO 3 ) 3 + NH 4 NO 3 + H 2 O
Hệ số cân bằng (nguyên, tối giản) của các chất trong sản phẩm lần lượt là:
A. 8, 3, 9
B. 2, 1, 4
C.8, 3, 15
D. 2, 2, 5
Dung dịch:
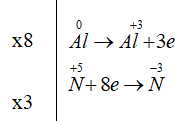
Hi vọng một số kiến thức mà chúng tôi mang đến trên đây có thể giúp các bạn Cân bằng phương trình Al+HNO3=Al(NO3)3+NH4NO3+H2O đặc & loãng. Chúc một ngày học tập vui vẻ.





























Ý kiến bạn đọc (0)