- Cách giải bài cân bằng phương trình NaOH + HCl = NaCl + H 2 O
- bài tập minh họa
- Làm thế nào để cân bằng một phương trình hóa học
- Cân bằng theo phương pháp truyền thống
- Cân bằng trong dãy kim loại-phi kim
- Phương pháp cân bằng phương trình chẵn lẻ
- Phương pháp từ phần tử phổ biến nhất
- Phương pháp cân bằng phương trình sử dụng hệ số thập phân
- Phương pháp đại số cân bằng phương trình
- Chi tiết cách giải bài tập: Cân bằng phương trình NaOH + HCl = NaCl + H 2 O
- NaOH là gì ?
- HCl là gì ?
- Điều kiện để NaOH và HCl kết hợp là gì?
- Điều gì xảy ra khi kết hợp NaOH và HCl ?
- Tham khảo danh sách các phản ứng NaOH khác
Cách giải chi tiết phương trình cân bằng NaOH + HCl = NaCl + H 2 O là một trong những dạng bài tập khó đối với học sinh. Và đây cũng là một trong những phương trình được đưa vào thử nghiệm nhiều nhất.
Vì vậy, chúng tôi hi vọng sẽ giúp ích cho các bạn về các bài tập cân bằng phương trình cũng như cách giải cân bằng phương trình NaOH + HCl = NaCl + H 2 O chi tiết nhất.
Cách giải bài cân bằng phương trình NaOH + HCl = NaCl + H 2 O
| NaOH | + | HCl | = | NaCl | + | H 2 O |
| Natri Hidroxit | axit hydrochloric | Natri clorua | quốc gia | |||
| hình thức mềm dẻo | dạng lỏng – không màu | dạng lỏng – không màu | chất lỏng – không màu | |||
| Cơ sở | axit | Muối ăn |
bài tập minh họa
Bài tập 1: Chất nào sau đây là phản ứng trung hòa?
A. NaOH + SO 2 → NaHSO 3
B. 2NaOH + CO 2 → Na 2 CO 3 + H 2 O
C. 2NaOH + CuSO 4 → Na 2 SO 4 + Cu(OH) 2
D. NaOH + HCl → NaCl + H 2 O
hướng dẫn giải
Phản ứng trung hòa là phản ứng NaOH + HCl → NaCl + H 2 O
Đáp án D .
Bài tập 2: Cho 0,1 mol NaOH phản ứng vừa đủ với 100ml HCl aM. giá trị của một là gì
A. 1. B. 0,001. C. 0,005. D. 0,1.
hướng dẫn giải
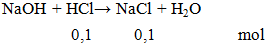
a = 0,1 : 0,1 = 1M.
Đáp án A. 1
Bài tập 3: Cho 100ml HCl 0,1M phản ứng vừa đủ với dung dịch NaOH thu được dung dịch X. Khối lượng các muối tan trong dung dịch X là
A. 0,765 gam. B. 0,585 gam . C. 7,585 gam. D. 7,454 gam.
hướng dẫn giải
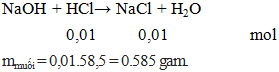
Đáp án B. 0,585g
Làm thế nào để cân bằng một phương trình hóa học
Đối với môn Hóa học, cân bằng phương trình luôn là nỗi ám ảnh của học sinh. Nhưng thật ra rất đơn giản để cân bằng các phương trình hóa học này. Tuy nhiên, có những phương trình mà nhiều chất tham gia phản ứng và tạo ra nhiều sản phẩm khiến học sinh khi gặp bài toán khó sẽ không cân bằng được phương trình. Dưới đây là một số phương pháp cân bằng phương trình giúp học sinh làm bài tập cân bằng phương trình hóa học dễ dàng, nhanh chóng và chính xác.
Trước hết học sinh cần thuộc lòng trình tự cân bằng một phương trình hóa học:
Bước 1: cân bằng nhóm nguyên tử (OH, NO 3 , SO 4 , CO 2 , PO 4 ..)
Bước 2: Cân bằng nguyên tử Hydrogen
Bước 3: cân bằng nguyên tử oxy
Bước 4: cân đối các yếu tố còn lại.
Cân bằng theo phương pháp truyền thống
Đang làm:
Viết phương trình đã cho. Trong ví dụ này, bạn sẽ có:
- C 3 H 8 + O 2 –> H 2 O + CO 2
- Phản ứng này xảy ra khi propan (C 3 H 8 ) bị đốt cháy trong oxy để tạo thành nước và carbon dioxide.
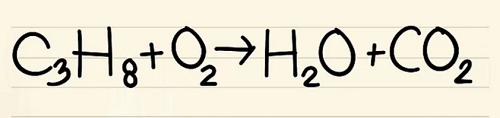
Bước 1:
Viết số lượng nguyên tử của mỗi nguyên tố mà bạn có ở mỗi bên của phương trình. Xem các chỉ số bên cạnh mỗi nguyên tử để tìm ra số lượng nguyên tử trong phương trình.
Còn lại: 3 carbon, 8 hydro và 2 oxy.
Đúng: 1 carbon, 2 hydro và 3 oxy.
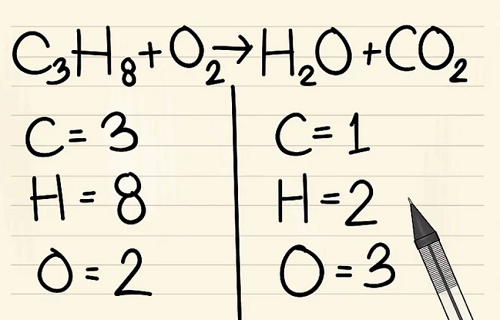
Bước 2:
Luôn đặt hydro và oxy cuối cùng
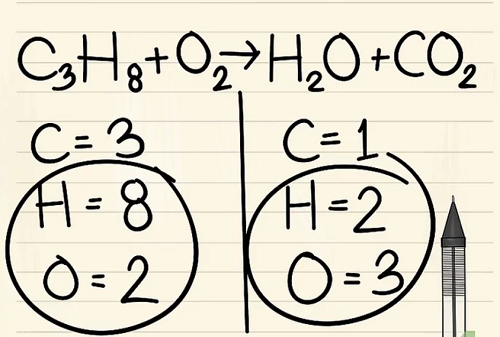
Bước 3:
Nếu bạn còn nhiều hơn một nguyên tố để cân bằng: hãy chọn nguyên tố chỉ xuất hiện trong một phân tử của chất phản ứng và chỉ trong một phân tử của sản phẩm. Điều này có nghĩa là trước tiên bạn sẽ cần phải cân bằng carbon.
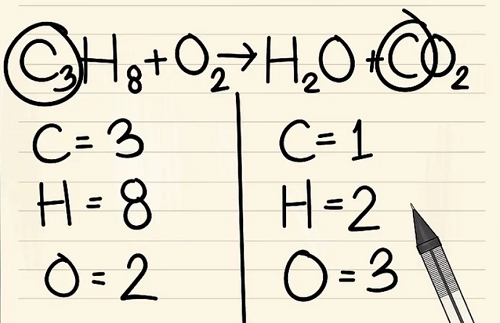
Bước 4:
Thêm hệ số cho carbon đơn vào phía bên phải của phương trình để cân bằng nó với 3 nguyên tử cacbon ở phía bên trái của phương trình.
- C 3 H 8 + O 2 –> H 2 O + 3CO 2
Hệ số 3 trước carbon ở phía bên phải biểu thị 3 carbon giống như chỉ số 3 ở phía bên trái biểu thị 3 carbon.
Trong một phương trình hóa học, bạn có thể thay đổi hệ số, nhưng không thể thay đổi chỉ số.

Bước 5:
Tiếp theo là cân bằng nguyên tử hydro. Bạn có 8 nguyên tử hydro ở bên trái. Do đó, bạn sẽ cần 8 ở bên phải.
C 3 H 8 + O 2 – > 4H 2 O + 3CO 2
Ngay bây giờ, bạn thêm 4 làm hệ số vì số thấp hơn cho biết bạn đã có 2 nguyên tử hydro.
Khi bạn nhân hệ số 4 với chỉ số 2, bạn sẽ nhận được 8.
6 nguyên tử Oxy còn lại là từ 3CO 2 .(3×2=6 nguyên tử oxy+ 4 nguyên tử oxy khác=10)

Bước 6:
Cân bằng nguyên tử oxi.
Vì bạn đã thêm các hệ số cho các phân tử ở vế phải của phương trình nên số lượng nguyên tử oxy đã thay đổi. Bây giờ bạn có 4 nguyên tử oxy trong phân tử nước và 6 nguyên tử oxy trong phân tử carbon dioxide. Tổng cộng chúng ta có 10 nguyên tử oxy.
Thêm hệ số 5 vào phân tử oxy ở vế trái của phương trình. Bây giờ bạn có 10 phân tử oxy ở mỗi bên.
C 3 H 8 + 5 O 2 – > 4H 2 O + 3CO 2 .
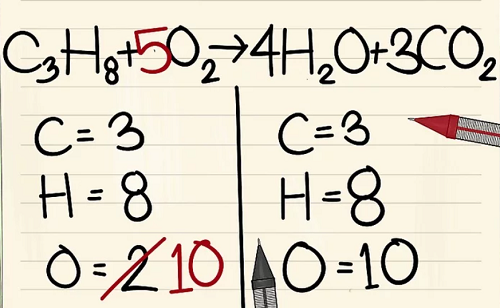
Kết quả
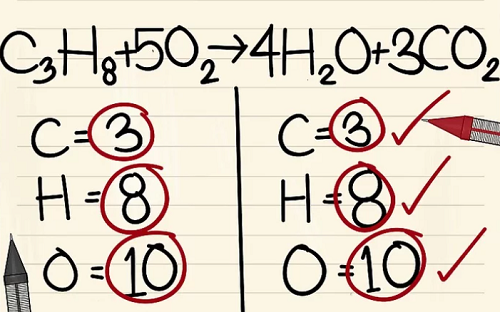
Cân bằng trong dãy kim loại-phi kim
Cân bằng một phương trình hóa học theo dãy Kim loại-Phi kim có nghĩa là chúng ta sẽ cân bằng số nguyên tử của kim loại trước, sau đó là phi kim, sau đó là Hiđro và sau đó là oxi.
Vd: CuFeS 2 + O 2 -> CuO + Fe 2 O 3 + SO 2
Vì nguyên tử Cu đã cân bằng nên bậc 1 của cân bằng sẽ là: Fe rồi đến Cu, S, O rồi nhân đôi hệ số ta có kết quả:
4CuFeS 2 + 13O 2 = 4CuO + 2Fe 2 O 3 + 8SO 2
Phương pháp cân bằng phương trình chẵn lẻ
Đây là một trong những cách dễ dàng và được sử dụng rộng rãi nhất để cân bằng phương trình hóa học. Với phương pháp này, học sinh có thể sử dụng phương pháp tính chẵn lẻ, được áp dụng như sau:
Khi phương trình cân bằng nghĩa là số nguyên tử của nguyên tố vế phải bằng số nguyên tử của nguyên tố vế trái tức là số nguyên tử của nguyên tố vế trái bằng chẵn , thì Số nguyên tử của nguyên tố đó ở vế phải cũng phải là số chẵn.
Vì vậy, nếu trong phương trình nếu một trong các số nguyên tử của bất kỳ nguyên tố nào là số lẻ, thì nó phải được nhân đôi.
Vd: Ta lấy lại ví dụ trên: Fe + O 2 -> Fe 2 O 3
Số nguyên tử Fe ở vế trái là số lẻ, vế phải là chẵn nên ta nhân Fe ở vế trái với 2. Oxy ở vế trái là chẵn, vế phải là lẻ nên ta cũng nhân 2 bằng số nguyên tử oxi ở vế phải.
2Fe + O 2 -> 2Fe 2 O 3
Lúc này số nguyên tử 2 bên là chẵn, ta chỉ cần cân bằng lại cho số nguyên tử 2 bên bằng nhau.
4Fe + 3O 2 = 2Fe 2 O 3
Phương pháp từ phần tử phổ biến nhất
Phương pháp phần tử phổ biến nhất có nghĩa là bất kỳ phần tử nào có mặt trong hầu hết các hợp chất trong phương trình được cân bằng, chúng tôi sẽ chọn phân tích các phân tử trước.
Vd: Cu + HNO 3 -> Cu(NO 3 ) 2 + NO + H 2 0
Trong phương trình này, nguyên tố Oxy xuất hiện nhiều nhất trong hầu hết các hợp chất nên sẽ cân bằng Oxy trước, sau đó mới đến các nguyên tố khác.
Vế trái có 8 oxi, vế phải có 3 oxi. Vậy bội số chung nhỏ nhất của 8 và 3 là 24 nên hệ số của HNO 3 là 24/3=8
Vậy cân bằng phản ứng là: 3Cu + 8HNO 3 = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
Phương pháp cân bằng phương trình sử dụng hệ số thập phân
Phương pháp này áp dụng như sau: đặt hệ số cho các chất phản ứng, có thể là số nguyên tố hoặc phân số miễn là số nguyên tử ở hai vế bằng nhau. Sau đó nhân lên để loại bỏ mẫu số chung ở cả hai bên.
Vd: Fe + O 2 -> Fe 2 O 3
Đầu tiên ta cộng hệ số trở thành: 2Fe + 3/2O 2 -> Fe 2 O 3
Lúc này số nguyên tử ở hai vế bằng nhau. Sau đó, chúng tôi nhân với giải mẫu, mà trong phương trình sẽ nhân với 2.
Kết quả là: 4Fe + 3O 2 = 2Fe 2 O 3
Phương pháp đại số cân bằng phương trình
Học sinh lần lượt đặt các hệ số a, b, c… vào công thức hai vế của phương trình rồi lập PTHH chứa các ẩn số trên theo nguyên tắc số hiệu nguyên tử của nguyên tố trước và sau phản ứng là bằng nhau. Bạn sẽ được một hệ phương trình chứa ẩn số, hãy giải hệ phương trình này và đưa các hệ số tương ứng vừa tìm được về phương trình phản ứng và giải mẫu (nếu cần).
Với bài toán cân bằng phương trình hóa học FeS 2 + O 2 –> Fe 2 O 3 + SO 2 , ta thấy, vế trái số nguyên tử O 2 chẵn với hệ số bất kỳ còn vế phải, trong SO 2 oxi là số chẵn nhưng trong Fe 2 O 3 là số lẻ nên phải tăng gấp đôi. Sau đó cân bằng các hệ số còn lại. 2Fe 2 O 3 –> 4FeS 2 –> 8SO 2 + 11O 2 , thay PTPU ta được phương trình cân bằng là 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 .
Chi tiết cách giải bài tập: Cân bằng phương trình NaOH + HCl = NaCl + H 2 O
NaOH là gì ?
NaOH là công thức hóa học của Natri hiđroxit hay còn gọi là xút hay xút ăn da là một hợp chất vô cơ của natri. Natri hydroxit tạo thành dung dịch bazơ mạnh khi hòa tan trong dung môi như nước.
Nhúng NaOH vào giấy quỳ tím chuyển sang màu xanh. NaOH được sử dụng nhiều nhất trong xử lý nước bể bơi, người ta sử dụng hóa chất NaOH để tăng pH nước bể bơi.
Dung dịch NaOH tồn tại ở thể lỏng, màu trắng, mùi đặc trưng, dùng trong hóa chất dệt nhuộm, luyện kim, y học, thuốc trừ sâu, chất tẩy rửa và giặt tẩy, làm giấy, sơn… phản ứng với các chất khử.
NaOH dễ hấp thụ CO2 trong không khí nên thường được bảo quản trong lọ kín. Ở dạng dung dịch, xút tạo thành monohydrat ở nhiệt độ 12,3 – 61,8 độ C, nhiệt độ nóng chảy 65,1 độ C và khối lượng riêng là 1,829 g/cm3.
HCl là gì ?
HCL (axit cloric) là một loại axit được sử dụng rộng rãi trong công nghiệp dược phẩm, hóa chất và dược phẩm, xây dựng các chế phẩm,…
Đối với Dung dịch, axit clohydric loãng (axit cloric) không màu, dung dịch HCL(axit cloric) đậm đặc nhất có nồng độ tối đa là 40% và có màu vàng lục. Ở dạng đậm đặc, axit clohydric (HCL) có thể tạo thành sương mù axit.
Ở thể khí, HCL(Axit Cloric) tồn tại không màu, mùi hắc, tan nhiều trong nước tạo thành dung dịch axit mạnh HCL(Axit Cloric); Nặng hơn không khí.
Vì HCL (axit cloric) là một axit, nên nó chắc chắn có tính chất của một axit làm giấy quỳ tím chuyển sang màu đỏ.
Điều kiện để NaOH và HCl kết hợp là gì?
- Ở nhiệt độ thường NaOH phản ứng được HCl
Điều gì xảy ra khi kết hợp NaOH và HCl ?
NaOH phản ứng với HCl, dung dịch bị mất màu, dung dịch NaOH phản ứng với axit, tạo thành muối và nước.
Nhỏ vài giọt dung dịch phenolphtalein vào cốc đựng dung dịch NaOH 0,10M, dung dịch lúc này sẽ có màu hồng. Ta châm từ từ dung dịch HCl 0,10M vào cốc trên, vừa rót vừa khuấy nhẹ. Để nhận biết phản ứng vừa đủ ta lắp buret chứa NaOH, bên dưới là cốc thủy tinh đựng dung dịch HCl vừa đủ trộn với dung dịch phenolphtalein.
Mở buret để NaOH nhỏ giọt từ từ. Lúc đầu, sau khi nhỏ từng giọt NaOH vào cốc đựng dung dịch HCl, ta thấy phenolphtalein có màu hồng.
Tuy nhiên, màu hồng sẽ biến mất khi NaOH được trung hòa. Đến khi thấy giọt NaOH rơi xuống tạo màu hồng bền > 5s thì phản ứng vừa đủ.
Hi vọng với một số kiến thức trên, các bạn đã biết cách cân bằng phương trình NaOH + HCl = NaCl + H2O để giải chi tiết phương trình cân bằng cũng như củng cố lại các kiến thức liên quan đến cân bằng phương trình. Xin vui lòng.
Tham khảo danh sách các phản ứng NaOH khác
H3PO4 + NaOH = H2O + NaH2PO4
Al + NaOH + H2O = NaAlO2 + H2
Al2O3 + NaOH = NaAlO2 + H2O
Al2O3 + NaOH + H2O = NaAl(OH)4
NaOH + Al(HO)3 = NaAlO2+H2O
AlCl3 + NaOH = Al(OH)3+NaCl
K2Cr2O7 + NaOH = K2CrO4+Na2CrO4+H2O
NaAlO2 + NaOH = Al(OH)3 + Na2O
NaOH + MgSO4 = Mg(OH)2+Na2SO4
NaOH + Na2CO3 = NaCO3 + Na2OH
NaOH + AgNO3 = Ag2O+H2O+NaNO3
Al2(SO4)3 + NaOH = Na2SO4+NaAlO2+H2O
NaOH + SiO2 = Si(OH)4 + Na2O
NaOH + Ca(HCO3)2 = CaCO3+Na2CO3+H2O
NaOH + HCl = NaCl + H2O
NaHCO3 + NaOH = Na2CO3 + H2O
NaOH + Al(OH)3 = NaAlO2 + H2O
NaOH + SO2 = Na2SO3 + H2O
NaOH + Cl2 = NaClO + NaCl + H2O
NaOH + H2SO4 = Na2SO4 + H2O
NaOH + NH4Cl = NH3 + H2O + NaCl
NaOH + CuSO4 = Na2SO4 + Cu(OH)2
NaOH + NO2 = NaNO2 + H2O + NaNO3
NaOH + P2O5 = Na3PO4 + H2O
NaOH + Si = Na4SiO4 + H2
NaOH + H2O = Na(OH)2 + H2
NaOH + NH4NO3 = NaNO3+H2O+NH3
NaOH + HNO3 = H2O + NaNO3
NaOH + Al2(SO4)3 =Al(OH)3+Na2SO4
NaOH + O2 = NaHO2
NaOH + BaCl2 = Ba(OH)2 + NaCl
NaOH + KCl = NaCl + KOH
NaOH + KHCo3 = K2Co3+Na2Co3+H2O
NaHSO4 + NaOH = Na2SO4 + H2O
NaOH + MgO = Mg(OH)2 + Na2O
NaOH + CO2 = Na2CO3 + H2O



























Ý kiến bạn đọc (0)